Saniona på vej til at blive et rigtigt Biotek-selskab

Hovedpunkter:
- Hovedkræfterne er sat ind på de to R&D-projekter for anvendelse af Tesomet mod specielle sygdomme. Der er tale om et begrænset antal patienter, der ikke i dag har adgang til effektiv medicinsk behandling.
Ønsket herom og vanskelighed med tests i praksis hos mennesker i de svært berørte patientgrupper forventes at lempe kravene til undersøgelser i faseforløbet. Det vil fremskynde tidsforløbet og reducere udgifterne. Best Case er at opnå den første FDA-godkendelse i 2022.
- Selskabets ledelse og organisation er blevet helt omlagt i år med en reel flytning til Waltham nær Boston, USA. Profilen er derfor ændret til en mere offensiv amerikansk biotech strategi. Ideen er et ønske om hurtig fremdrift for Tesomet-projektet, der er rettet mod salg i USA og derfor skal godkendes af FDA som et nyt produkt.
Ud over en ledelsesmæssig ændring er staben af medarbejdere udvidet til nu 30. Ressourceindsats og cash burn øges for at opnå fremgang i R&D-forløbet.
- Økonomisk har man oprustet ved tilførsel af kapital, og herved er ejerkredsen udvidet. Der må forventes markant højere R&D-indsats og dermed cash burn, da der sættes turbo på udviklingen.
Den likvide reserve rækker frem til H2 2022, men det vil afhænge af undersøgelsesresultaterne og eventuelle nye krav/forkortelse i Tesomet projektet. Der er mulighed for indtægter, hvis Boehringer Ingelheim i 2021 tager udviklingsprojektet rettet mod skizofreni i fase 1. Det vil udløse en milepælsbetaling.
Der vil være udsigt til gode royalty indtægter (+ en milepæl?), hvis fedmelægemidlet Tesonfensine i nær fremtid godkendes i Mexico.
- Saniona har været medstifter af Cephagenix. Hensigten er at udvikle et lægemiddel mod migræne baseret på Saniona´s ionkanal kompetencer og viden om centralnervesystemet. Efter et års samarbejde (2021) vil Saniona få en ejerandel på 33,3 % af det nye selskab. Der foreligger ikke oplysninger om, hvorvidt ejerskabet vil medføre økonomisk bidrag til driften.
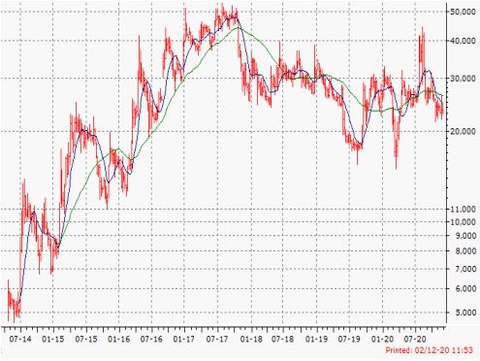
- Vi vurderer, at en co-notering af aktien i USA vil øge selskabets synlighed og tiltrække nye biotekinvestorer. Kursmæssigt har 2020 været skuffende. Det må skyldes udvandingen af aktien som følge af de markante udvidelser i antallet af udestående aktier.
- På R&D-siden er ikke alt forløbet som ønsket, men det er jo et vilkår i denne branche. Der kommet et Stop for det ene samarbejde med Boehringer Ingelheim og ligeledes med University of Pennsylvania.
Udviklingen af Tesomet mod PraderWilli og hypothalamisk fedme er blevet mødt med behov for fase 2b studier – altså ikke et direkte spring fra de ellers lovende fase 2a forsøg til fase 3. Tidsmæssigt forlænger det udviklingen med formentlig et halvt år.
- Vi mener, at Saniona er en særdeles spændende investeringscase. Investering i biotek indebærer per definition høj risiko og lang tidshorisont. Desuden skal man være parat til eventuelt at supplere op, hvis der måtte komme nye kapitalrejsninger.
Risikoen er øget som følge af partneres stop af to projekter (nu 8 aktive projekter) og tidspunktet er nu kommet med en nært forestående afgørelse om produktgodkendelse af Tesofensine i Mexico og endelig er der uklarhed omkring næste skridt i udviklingsforløbet for Tesomet mod hypothalamisk fedme.
Aktievurdering:
|
Aktuel Kurs: 21,5 SEK |
Kursudvikling 0-6 mdr.: 20-35 (før 25-35) |
Selskabets forventninger
Ledelsen fremlægger ingen finansielle mål for fremtiden. Fokus hos ledelsen (og investorerne) er rettet mod nyheder om udviklingsarbejdet og fremdriften heri.
Fakta om Saniona:
- Saniona er en dansk biopharmaceutisk virksomhed etableret i 2012 med børsnotering i Sverige siden 2014 (tickerkode: SANION). Hovedsædet er beliggende i Glostrup. Kontoret i USA er placeret i Waltham, Massachusetts.
- Saniona fokuserer på udvikling af medicin rettet mod sygdomme i centralnervesystemet (CNS) i form af spiseforstyrrelse, ataksi, kroniske smerter, neurologiske sygdomme og skizofreni samt metaboliske sygdomme (fedme, diabetes mv.). Ionkanalmodulering er Saniona’s afgørende metodemæssige vinkel til at udvikle nye lægemidler mod alvorlige sygdomme.
Pipelinen består aktuelt af 8 aktive projekter, hvoraf de fire udvikles for egen regning, mens de andre fire finansieres af det store tyske medicinalselskab Boehringer Ingelheim, Medix og Cadent Therapeutics (Saniona ejer 2,91 % af dette selskab).
- Strategien er at opfinde og udvikle bedre medicinsk behandling end de nuværende produkter eller at dække sygdomsområder uden nogen medicin. For at reducere risikoen og cash burn-raten er der indgået spin-outs samt partnerskabsaftaler, hvorved partnerne afholder udviklingsomkostningerne helt eller delvist.
Saniona afgiver for sin del størstedelen af upside potentialet men vil ved succes få milepælsbetalinger i løbet af R&D-forløbet og til sidst royaltyindtægt på en- eller to-cifrede procentsatser af et eventuelt produktsalg efter en godkendelse. Partnerskabsaftalerne dækker som udgangspunkt rettighederne globalt. For Tesofensine dækker det dog kun Mexico og Argentina.
- Aktien blev børsnoteret i Sverige i 2014 til kurs 5 SEK. Siden er der gennemført en række aktieemissioner.
- Ledelsesmæssigt er der i år sket store ændringer. Rami Levin (født 1969) med en fortid som President for Sobi i Nordamerika tiltrådte som CEO pr. 07-01-2020. Han afløste Jørgen Drejer (født 1955), der nu er CSO (Chief Scientific Officer). Jason A. Amello (født 1968) er CFO. Linea Aspesi (født 1970) er HR-chef. Rudolf Baumgartner (født 1959) er CMO (Chief Medical Officer). Trista Morrosin (født 1977) er Chief Communication Officer. Ledelsesgruppen bortset fra Jørgen Drejer er nu bosat i USA og arbejder derfra.
Saniona bevæger sig således målrettet mod opbygning af en ledelse med base i USA, hvor Rami Levins kernekompetencer omkring ledelse, salg og marketing af produkter mod sjældne sygdomme og CNS-produkter ligger. J. Donald deBethizy er formand for bestyrelsen.
- Saniona beskæftigede pr. 30-09-2020 i alt 30 medarbejdere, heraf 6 på deltid og resten på fuld tid. Det er en stigning fra 24 på samme tid sidste år. Der er en ligelig fordeling på køn. 24 arbejder med forskning og udvikling. 12 ansatte har en PhD, 5 en universitetsuddannelse, 9 har laboratorieuddannelse og 4 har andre uddannelser.
- Aktionærforhold pr. 31-10-2020: RA Capital Management 18,6 %, Pontifax Venture Capital 7,7 %, Avanza Pension 4,3 %, Jørgen Drejer 3,8 %, New Leaf Ventures 3,8 %. De ti største aktionærer ejer 50,4 %. Man har i alt 8.395 aktionærer (6.219 på samme tid sidste år).
Styrket likviditet via emissioner og lån
I årets løb er det likvide beredskab styrket gevaldigt til 647 mio. SEK pr. 30-09. Det er sket via optagelse af et lån på 25 mio. SEK hos Formue Nord og en rettet emission til selvsamme også på 25 mio. SEK. Desuden har to emissioner rettet mod de bestående aktionærer indbragt brutto 57 mio. SEK.
Denne emission er opdelt i tre trancher, og den sidste gennemføres i april måned til en kurs på 25-30 SEK. For at sikre en succesfuld tegning kræver det, at børskursen ligger i eller over dette prisinterval.
Saniona har desuden solgt ud af aktieposten i Scandion Oncology med et provenu på 105 mio. SEK til følge. Saniona ejer fortsat en aktiepost på 5-9,99 % af Scandion Oncology, som er et selvstændigt børsnoteret (på Spotlight i Sverige) spin-out fra Saniona.
Og endelig hentede man i august hele 567 mio. SEK brutto via udstedelse af nye aktier til en kreds af amerikanske og internationale institutionelle investorer (RA Capital Management, Pontifax Venture Capital, New Leaf Venture Partners, Second Swedish National Pension Fund, The Third Swedish National Pension Fund og The Fourth Swedish National Pension Fund). Denne emission fandt sted med en discount på hele 45 % på aktiekursen.
De mange emissioner har udvidet antal udestående aktier fra 28.041.441 styk til nu 62.372.831 aktier.
Styrkelsen af kapitalberedskabet rækker ved uændret cash-burn, jf. ledelsen, til H2 2022.
Tilførslen af penge har givet økonomisk styrke til at løfte R&D-projekterne fremad i et godt tempo. Saniona er nemlig i fase 2 med udsigt til overgang til fase 2b/3 for to af selskabets egne projekter med Tesomet rettet mod to sjældne sygdomme inden for spiseforstyrrelse, Prader-Willi syndrom (PWS) og hypothalamisk fedme (HO).
Selv der nu er penge frem til H2 2022 kan nye aktieemissioner udover den planlagte i april 2021 ikke udelukkes. Sådan er vilkårene for investeringer i selskaber, der udvikler nye lægemidler. I årets første tre kvartaler har man omsat for 4,6 mio. SEK og haft et nettounderskud på 117,3 mio. SEK, altså Cash Burn.
Organisationen i USA opbygges og medarbejdertallet stiger
Saniona har fokus på at opbygge en organisation i USA for at fremme udviklingen i selskabets to senfase studier vedrørende PWS og hypothalamisk fedme. Lokal tilstedeværelse i USA indebærer, at man er tættere på FDA og potentielle nye US-investorer inden for biotech (gør en co-notering i USA nemmere).
Samtidig kan man opbygge en organisation i USA til en kommende salgsudrulning, når/hvis der opnås FDA-godkendelse for salg og markedsføring af Tesomet rettet mod Prader-Willi og hypothalamisk fedme. Rami Levin overtog CEO-posten i starten af året, og han har målrettet drejet fokus mod USA og udvidet ledelsesgruppen ved ansættelse af personer, der er bosat i USA.
Antal medarbejdere er på et år udvidet fra 24 til nu 30 personer, hvilket øger overhead udgifterne. Det er fuld fart frem, og man har således allerede udnævnt en HR-chef, selv om der kun er 30 medarbejdere. Højt tempo i udviklingen er kort sagt vigtigere end stram udgiftsstyring.
Vigtig afgørelse for Tesofensine er nært forestående – en potentiel kurstrigger
Tesofensine rettet mod fedme og dermed som forebyggelse mod diabetes 2 er udlicenseret for så vidt angår Mexico og Argentina til partneren Medix, der i december 2019 indsendte ansøgning til de mexicanske sundhedsmyndigheder.
En afgørelse fra sundhedsmyndighedernes side er planlagt til slut 2020/start 2021. Covid-19 kan dog føre til en forsinkelse af afgørelsen, men uanset hvad, så nærmer tidspunktet sig.
Medix sidder i dag på ca. 50 % af det mexicanske fedmemarked. Markedet estimeres til ca. 250 mio. USD. Det interessante er, at markedet kan blive udvidet markant, hvis Tesofensine vinder indpas. Behovet for effektiv behandling er nemlig stort, da 90 millioner mexicanere skønnes at være overvægtige.
Mange har fravalgt behandling, da de nuværende produkter giver bivirkninger. Hvis Tesofensine kan overtage Medix's nuværende salg på 125 mio. USD om året i Mexico, vil indtægterne til Saniona blive store (og tallet stiger, hvis markedet udvides). Saniona er berettiget til royalty-indtægter (tocifret procentsats - formentlig i niveauet 15 %).
Vi tillægger denne afgørelse stor betydning, da en godkendelse vil kunne generere pæne løbende indtægter. Sanionas fokus er dog primært rettet mod projekterne angående Prader-Willi og hypothalamisk fedme.
Pipelinens udvikling og status
Pipelinen har fået to tilbagefald i år, og antallet af aktive udviklingsprojekter er faldet fra 10 til 8. Samarbejdspartneren Boehringer Ingelheim har valgt at stoppe samarbejdet omkring GABAa5, som var i præklinisk fase. Alle rettigheder er leveret tilbage til Saniona. Derved mister man en sponsor for den videre udvikling.
Projektet er sat på pause, idet Saniona næppe selv har finansielt råderum til videre udvikling.
Desuden er samarbejdet omkring NS2359 rettet mod kokainafhængighed med The Treatment Research Center at the University of Pennsylvania også blevet stoppet og alle rettigheder er leveret tilbage til Saniona. Projektet forekom ellers lovende i vores optik, men partneren har i flere år udvist begrænset interesse for videre udvikling.
Set i det lys giver det god mening at stoppe samarbejdet. Saniona har endnu ikke meldt ud om nye planer for NS2359, men det giver mulighed for indgåelse af samarbejde med andre partnere. For nærværende er projektet derfor sat på pause, og vi tillægger ikke projektet nogen økonomisk værdi.
Sanionas egne projekter i pipelinen:


Tesomet er et kombinationsprodukt af Tesofensine og Metoprolol. Tesofensine medfører stigende puls, hvilket modvirkes ved tilføjelsen af Metoprolol. Tesomet er patentbeskyttet i USA frem til 2036. Tesomet udvikles til behandling af spiseforstyrrelser som Prader-Willi syndrom (PWS) og hypothalamisk fedme (HO). Saniona ejer rettighederne, og forsøg gennemføres for egen regning.
Prader-Willi syndrom er en sjælden sygdom, som skyldes en medfødt fejl i kromosom 15, hvorved de berørte ikke kan opnå eller mærke mæthed. Sygdommen forekommer i en ud af 15.000 fødsler. De berørte personer lider ofte af neurologiske handikap (retarderede), hvilket gør det vanskeligt for dem at forstå, hvor alvorlig deres sygdom er. De kan reelt spise sig ihjel. Der findes ingen medicinsk behandlingsmulighed. Saniona står potentielt med et ”first-in-class” produkt.
Fase 2a forsøg med voksne blev sidste år afsluttet med de ønskede data (proof of concept). Ekstra fase 2a forsøg med voksne og teenagere har bekræftet en positiv effekt. I første halvår er der gennemført møder med FDA med henblik på at tilrettelægge det videre udviklingsforløb.
Saniona har modtaget positiv feed-back fra FDA, og der er enighed om retningslinjerne for fase 2b/3 forsøg, der forventes igangsat i H1 2021. Oprindelig havde vi forventet igangsættelse inden udgangen af i år. FDA vil måske tildele dette forsøg 505(b)2 status, hvilket giver mulighed for at få en FDA-godkendelse uden at udføre alt det arbejde, der normalt kræves med en NDA (New Drug Application). Det er vigtigt, da det i så fald vil reducere Saniona´s omkostninger ved at gennemføre de sidste forsøg.
Tidsrammen for, hvornår Saniona kan stå med et færdigt og godkendt specialprodukt (first-in-class), er ikke klar. Vi har tidligere estimeret 2022, men måske rykkes tidspunktet ind i 2023. Der er altså tale om kort tid i pharma sammenhæng.
Trods det begrænsede markedsgrundlag rummer Prader-Willi projektet et stort værdipotentiale. Jævnfør oplysninger i Saniona´s forrige årsrapport estimeres den årlige pris pr. behandlet patient til at kunne ligge i prisniveauet 60.000-150.000 USD, så Tesomet mod Prader-Willi kan potentielt opnå Block-buster status (årligt salg over 1 mia. USD).
Hypothalamisk fedme: Parallelt med forsøg mod Prader-Willi har selskabet i april meldt om positive data fra et fase 2a proof-of-concept studie rettet mod hypothalamisk fedme.
Forsøget løb over 24 uger og viste en sikker og veltolereret behandling med et betydeligt vægttab. Der pågår forhandlinger med FDA om udformning og krav til de videre forsøg. Ekstra krav fra FDA´s side gør dog, at man er nødt til at gennemføre et fase 2b forsøg, og det forventes igangsat i H1 2021 – altså ikke en direkte overgang til fase 3. Så også her rykkes tidsplanen.
Vi har tidligere vurderet, at best case kunne være at få godkendt et sådant lægemiddel i 2022, men tidsrammen må nok forlænges ind i 2023.
Hypothalamisk fedme kan skyldes en godartet hjernetumor, der rammer 1 ud af ca. 50.000-100.000 i USA. Hovedparten får ødelagt deres appetitcenter enten som følge af tumoren eller operation.
Der er også andre patientgrupper. Nogle får ødelagt appetitcentret som følge af slagtilfælde, mens det for andre kan indtræffe i forbindelse med ulykker. Operation er meget vanskelig, og en negativ sideeffekt er, at patienterne tager på i vægt. Også med hypothalamus kan salget blive væsentligt, selv om der er tale om en mindre patientgruppe end antallet af mennesker, der rammes af Prader-Willi syndromet.
SAN711-projektet mod kronisk kløe og smerte har afsluttet de prækliniske studier og er klar til opstart af fase 1 forsøg i H1 2021. SAN-711 udviser færre bivirkninger end behandling af smerter med fx Valium. Hensigten er at finde en måde, hvorpå nervebanerne påvirkes, så kroppen selv kan regulere og ”kurere/reducere” kroniske smerter og kløe.
Der findes ingen effektive lægemidler til at afhjælpe disse gener. SAN711 har derfor potentiale til at blive ”first-in-class”. Omfanget kan blive stort. Vi forventer, at Saniona vil inddrage en partner på et tidspunkt.
SAN903 rettet mod inflammation er i præklinisk fase og forventes at gå i fase 1 i H1 2022.
Udlicenserede projekter
Her er pipelinen blevet reduceret fra 6 til 4 projekter som følge af stop for samarbejdet omkring NS2359 og GABAa5 projektet.
CAD-1883: Saniona ejer 2,91 % af partneren, Cadent Therapeutics, der med succes har færdiggjort et fase 2a forsøg mod rystesyge. Igangsættelse af et fase 2a forsøg mod ataksi ventes i nær fremtid. Cadent har tidligere indikeret, at en tredje indikation kan komme på tale.
Boehringer Ingelheim: I samarbejde med det tyske medicinalselskab videreføres nu kun et udviklingsprojekt rettet mod skizofreni. Boehringer Ingelheim vil formentlig tage dette prækliniske udviklingsprojekt til fase 1 næste år, hvilket i så fald vil udløse en milepælsindtægt.
Rammen for samarbejdet er på 76,5 mio. EUR. Det er en ren win-situation for Saniona, men det endelige resultat og alle beslutninger omkring stop/go ligger i hænderne på partneren. Tidsmæssigt vil der blive tale om en meget lang årrække.
Styrker – Svagheder – Muligheder – Trusler
Styrker: Pipelinen er rettet bredt. Kompetencer inden for ionkanaler udgør den faglige spidskompetence. Man har mulighed for at indgå partneraftaler. Tesofensine er nået til produktgodkendelse i Mexico. Egne projekter med Tesomet er inde i fase 2.
Svagheder: Tesofensine er gået ud af patentbeskyttelse, og man er afhængig af partnerens indsats både omkring en produktgodkendelse og efterfølgende også i deres salgsindsats. De to projekter med Tesomet ligger så tæt op ad hinanden, at fejler det ene, så gør det andet formentlig også.
Muligheder: Godkendelse af Tesofensine i Mexico vil åbne for royalties. Der findes ingen behandling af Prader-Willi eller hypothalamisk, fedme – altså mulighed for at opnå ”first-in-class” status for Tesomet lægemidlet. Selskabet har mulighed for at indgå partneraftaler for sine egne igangværende projekter.
Trusler: Største risiko er uventede udfordringer (virkning og bivirkninger) i udviklingsarbejdet. Som et mindre selskab vil man blive ramt meget hårdt, såfremt et eller flere af de igangværende senfase studier fejler. Selv lovende udviklingsprojekter i senfase kan vise sig at være værdiløse. Generelt er R&D afgørende i medicinindustrien, og konkurrenter kan overhale med et bedre produkt.
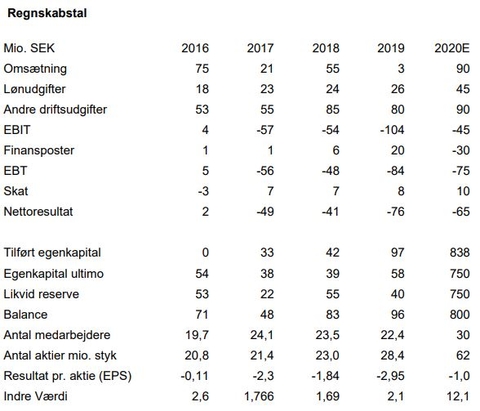

NB: Vi budgetterer en indtægt på 10 mio. USD baseret på, at Medix opnår godkendelse af Tesofensine i Mexico. Dette skøn er behæftet med stor usikkerhed, idet Saniona ikke selv har meddelt, om og hvor stor en sådan milepæl måtte blive. Tidspunktet kan meget vel blive rykket til ind i 2021.
Nærværende analyse er udarbejdet efter anmodning af Saniona, og Aktieinfo modtager honorar for udfærdigelsen af denne analyse, der desuden har været forelagt selskabet. Analysen og konklusionerne heri er alene udarbejdet af Aktieinfo og kan ikke påvirkes af selskabet. Aktieinfo, John Stihøj og/eller Lau Svenssen ejer aktier i Saniona på tidspunktet for analysen.





